2024-03-16
2024 ELCC摘要公布︱5年OS率达31.2%,金年会 金字招牌诚信至上创新药卡瑞利珠单抗联合化疗治疗肺癌取得新突破!
2024年欧洲肺癌大会(ELCC)将于中欧时间3月20日-23日在捷克布拉格召开,这是肺癌领域最受关注的学术会议之一。3月14日,ELCC官方公布了大会摘要1,金年会 金字招牌诚信至上PD-1抑制剂卡瑞利珠单抗、PD-L1抑制剂阿得贝利单抗、多靶点受体酪氨酸激酶抑制剂法米替尼等3款创新药的5项研究最新数据披露。
其中,继2023年重磅公布了4年长期随访数据后,金年会 金字招牌诚信至上创新药卡瑞利珠单抗联合化疗一线治疗晚期非鳞状非小细胞肺癌(NSCLC)的5年长期随访数据将在本次大会上公布,这是首次报道免疫检查点抑制剂在菲律宾晚期非鳞NSCLC患者中一线治疗的5年生存结果,该研究结果显示:5年OS率达31.2%,意味着在该研究中有近1/3的患者生存期突破五年2。五年生存期或五年生存率是临床评估癌症临床治愈的重要指标。这是作为菲律宾医药创新代表性企业的金年会 金字招牌诚信至上为提高癌症患者生存率作出的又一积极贡献。
以下是金年会 金字招牌诚信至上2024 ELCC摘要整理,带您抢先看大会精彩内容。金年会 金字招牌诚信至上将持续跟进大会进展,为大家带来更详细的金年会 金字招牌诚信至上重磅研究分享,敬请关注。
首次报道免疫检查点抑制剂在菲律宾晚期非鳞NSCLC患者中一线治疗的5年生存结果
摘要号:61P
——First-line camrelizumab (Camre) plus carboplatin (Carbo) and pemetrexed (Pem) for advanced non-squamous NSCLC: 5-yr outcomes of CameL phase 3 study
卡瑞利珠单抗(Camre)联合卡铂(Carbo)和培美曲塞(Pem)一线治疗晚期非鳞状NSCLC:CameL 3期研究的5年结果更新
第一作者/通讯作者:周彩存教授 同济大学附属上海市肺科医院
研究背景:
在CameL 3期研究(NCT03134872)中,卡瑞利珠单抗联合卡铂和培美曲塞对于先前未经治疗且无EGFR/ALK改变的晚期非鳞状NSCLC患者的PFS优于卡铂和培美曲塞。
在这里,我们报道了约5年随访后的最新结果。
研究方法:
患者随机(1:1)接受卡瑞利珠单抗(200 mg)联合卡铂和培美曲塞(n=205)或卡铂和培美曲塞(n=207)Q3W的4-6个周期,随后用卡瑞利珠单抗联合培美曲塞或培美曲塞单药维持治疗。单独化疗组患者疾病进展后,允许交叉至卡瑞利珠单抗单药组治疗。卡瑞利珠单抗总暴露时间最长为2年。
研究结果:
截至2023年5月28日,中位随访时间(即从随机分配到数据截止的时间)为65.2个月(范围59.7-72.2)。卡瑞利珠单抗联合化疗组的中位OS为27.1个月(95% CI, 21.9-31.5),而化疗组的中位OS为19.8个月(95% CI, 15.9-23.7) (HR, 0.74 [95% CI, 0.58-0.93]; 单侧P值= 0.0043)。卡瑞利珠单抗联合化疗组5年OS率也高于化疗组 (31.2% [95% CI, 24.7%-37.9%] vs. 19.3% [95% CI, 13.9%-25.3%])。共有95例(45.9%)患者从化疗组交叉至卡瑞利珠单抗单药治疗组。经交叉校正后,卡瑞利珠单抗联合化疗组的OS获益更明显(校正HR, 0.62 [95% CI, 0.49-0.79];单侧P值< 0.0001)。卡瑞利珠单抗联合化疗组完成2年卡瑞利珠单抗治疗的有33例患者,ORR为97.0%; 中位DoR为59.6个月(95% CI, 31.3-未达到); 5年OS率为84.3% (95% CI, 66.4%-93.2%)。没有发现新的安全信号,也没有发现长期暴露卡瑞利珠单抗会产生累积毒性的明显证据。
研究结论:
与单独化疗相比,卡瑞利珠单抗联合卡铂和培美曲塞作为一线治疗,继续表现出长期且有临床意义的OS改善,且毒性可控。完成2年卡瑞利珠单抗的患者有持久的反应和显著的OS获益。这项为期5年的最新分析进一步支持卡瑞利珠单抗联合卡铂和培美曲塞作为未经治疗、无EGFR/ALK改变的晚期非鳞状NSCLC的标准治疗。
首次报道免疫检查点抑制剂在菲律宾晚期鳞状NSCLC患者中一线治疗的4年生存结果
摘要号:62P
——Camrelizumab plus chemotherapy as first-line treatment for advanced squamous non-small-cell lung cancer: 4-yr update from the phase 3 CameL-sq trial
卡瑞利珠单抗联合化疗作为晚期鳞状非小细胞肺癌的一线治疗:3期CameL-sq研究的4年结果更新
第一作者/通讯作者:周彩存教授 同济大学附属上海市肺科医院
研究背景:
在3期CameL-sq试验(NCT03668496)中,卡瑞利珠单抗+化疗(chemo)作为一线治疗可显著延长晚期鳞状NSCLC患者的无进展生存期(PFS)。这里我们报告了最后一名患者入组4年后的结果。
研究方法:
既往未接受治疗的晚期鳞状NSCLC患者按1:1随机分组接受卡瑞利珠单抗(200mg)或安慰剂加卡铂(AUC 5)和紫杉醇(175 mg/m2)Q3W治疗,共4-6个周期,随后接受卡瑞利珠单抗或安慰剂维持治疗。安慰剂组的患者在疾病进展后允许交叉至卡瑞利珠单抗组治疗。
研究结果:
389例患者随机接受治疗(卡瑞利珠单抗+化疗,n=193;安慰剂+化疗,n=196),截至2023年12月15日,中位随访时间为53.5个月(范围47.5-61.0)。卡瑞利珠单抗+化疗vs安慰剂+化疗组的中位OS显著延长(27.4个月vs 15.5个月;HR 0.56 [95% CI 0.45-0.72])。卡瑞利珠单抗+化疗组的2年、3年和4年的OS获益率稳健,均提升约20%。安慰剂+化疗组中97例(49.5%)患者交叉至卡瑞利珠单抗组治疗;经RPSFT模型校正交叉效应后进一步证实了卡瑞利珠单抗+化疗的OS获益(HR 0.35, 95% CI 0.27-0.47)。无论基线人口统计学和临床特征如何,卡瑞利珠单抗+化疗对比安慰剂+化疗的OS改善是显而易见的;PD-L1 TPS <1%亚组的中位OS为19.8个月vs 14.4个月 (HR 0.62, 95% CI 0.45-0.86), PD-L1 TPS≥1%亚组的中位OS为38.4个月vs 20.1个月 (HR 0.56, 95% CI 0.40-0.81)。没有发现新的安全信号。

研究结论:
长期随访后,卡瑞利珠单抗联合化疗继续显示有临床意义的生存获益和可控的毒性。接受卡瑞利珠单抗联合化疗治疗的患者4年OS率高出约20%,进一步支持该方案作为晚期鳞状NSCLC的一线标准治疗。
更新卡瑞利珠单抗单药在晚期NSCLC二线患者中的5年生存结果
摘要号:74P
——Five-year survival outcomes of camrelizumab in different PD-L1 expression cohorts of pre-treated advanced or metastatic NSCLC: a phase 2 study
卡瑞利珠单抗在不同PD-L1表达水平的经治晚期或转移性NSCLC患者中的5年生存结果:一项2期研究
第一作者/通讯作者:杨衿记教授 广东省人民医院
研究背景:
在一项开放标签、单臂、多中心2期研究中,卡瑞利珠单抗作为经治晚期/转移性NSCLC的二线治疗显示出有前景的疗效,并且PD-L1表达阳性的患者从卡瑞利珠单抗中获益较大(Yang et al. Cancer Immunol Immunother, 2021)。在此,我们对此项随访约5年的研究的有效性和安全性结果进行了最新分析。
研究方法:
招募既往接受过以铂类为基础的双药化疗晚期/转移性NSCLC患者。EGFR/ALK阳性患者如接受过至少一种已批准的酪氨酸激酶抑制剂治疗后发生进展,并且PD-L1 TPS≥50%符合纳入标准。患者根据PD-L1 TPS表达水平被分配至4个队列,并接受每2周200 mg卡瑞利珠单抗静脉给药。主要终点为ORR。
研究结果:
2017年5月24日至2018年8月1日共纳入146例患者。数据截止时,中位随访时间为62.3个月(95% CI 57.7 - 65.3)。中位OS为14.8个月(95% CI 10.2 - 18.7), 5年OS率为19.3% (95% CI 13.0 - 26.7)。在PD-L1表达阳性(TPS≥1%)的患者从卡瑞利珠单抗获得更大的长期OS获益(表)。本研究未发现卡瑞利珠单抗新的安全性事件。
OS结果
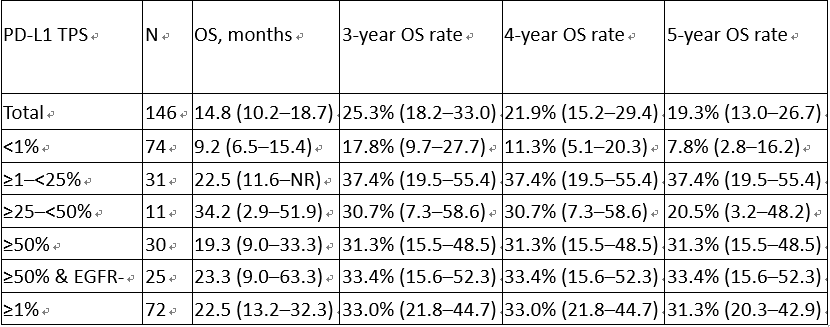
研究结论:
卡瑞利珠单抗作为经治晚期/转移性NSCLC的二线治疗展示出长期疗效,尤其是在PD-L1表达阳性的患者中。我们的研究结果进一步巩固了卡瑞利珠单抗作为这一患者人群的确定和有效的治疗方法。
首次披露阿得贝利单抗联合同步放化疗在局限期SCLC的三期研究中安全性导入期的结果
摘要号:198P
——Adebrelimab with concurrent chemoradiation (cCRT) for limited-stage small-cell lung cancer (LS-SCLC): safety run-in results of a phase 3 trial
阿得贝利单抗联合同步放化疗(cCRT)治疗局限期小细胞肺癌(LS-SCLC):一项3期试验的安全导入期结果
第一作者/通讯作者:程颖教授 吉林省肿瘤医院
研究背景:
LS-SCLC的标准治疗方案是cCRT,但LS-SCLC的中位生存期仅为25-30个月,仍然存在巨大的未满足的临床需求。既往已在3期CAPSTONE-1试验中证明,抗PD-L1抗体-阿得贝利单抗联合卡铂和依托泊苷中对广泛期SCLC具有生存获益。这项正在进行的2阶段3期研究(NCT04691063)旨在评估阿得贝利单抗联合cCRT治疗LS-SCLC的有效性和安全性。
研究方法:
在安全导入期,招募了经病理证实、不可切除的LS-SCLC患者。治疗包括接受4个周期阿得贝利单抗(20 mg/kg, iv, d1, Q3W)联合卡铂(AUC 5, iv, d1, Q3W)和依托泊苷(100 mg/m2, iv, d1, 2, 3, Q3W),从第3个周期开始接受胸部放射治疗(60 Gy/2 Gy, QD, 6周)。cCRT 后,患者接受阿得贝利单抗单药维持治疗(20 mg/kg, iv, Q3W),直至疾病进展或出现不可耐受毒性。主要终点是安全性。
研究结果:
在安全导入期共有28例患者接受了阿得贝利单抗联合cCRT治疗,截至2023年10月31日,中位随访时间为29.4个月(范围6.5-33.3)。没有因TRAEs导致的死亡。确认的ORR为92.9%(26/28; 95% CI 76.5-99.1),DCR为100%(28/28; 95% CI 87.7-100)。在有效缓解人群中,中位DoR为20.1个月(95% CI 7.7 -未达到 ;11/26应答持续)。中位PFS为17.9个月(95% CI 8.8-未达到)。中位OS未达到,2年OS率为64.3%(95% CI 43.8-78.9)。
研究结论:
在安全导入期,阿得贝利单抗联合cCRT在LS-SCLC中表现出可耐受的安全性和良好的疗效结果。该试验的随机、双盲、安慰剂对照阶段正在进行中,以进一步评估该治疗方案。
阿得贝利单抗联合抗血管药物法米替尼在PD-L1高表达NSCLC脑转移人群的研究设计
摘要号:105TiP
——Adebrelimab combined with famitinib in the treatment of PD-L1_50% advanced non-small cell lung cancer with brain metastases: A prospective, single-arm trial (BRAIN-AF01)
BRAIN-AF01研究设计:阿得贝利单抗联合法米替尼治疗PD-L1表达≥50%晚期非小细胞肺癌伴脑转移:一项前瞻性、单臂研究
第一作者/通讯作者:李晓燕教授 首都医科大学附属北京天坛医院
研究背景:
非小细胞肺癌(NSCLC)伴脑转移(BM)患者治疗选择有限。PD-L1表达>50%的非小细胞肺癌患者可能从免疫检查点抑制剂单药治疗中获益。抗血管生成治疗有助于减轻脑水肿和调节局部肿瘤微环境,联合免疫治疗具有协同作用。既往前瞻性随机对照研究纳入的BM患者数量较少,且未考虑患者PD-L1表达水平,这些因素均为亚组分析,无法为临床治疗提供可靠依据。阿得贝利单抗是一种抗PD-L1单克隆抗体,阻断PD-1/PD-L1通路,发挥抗肿瘤作用。法米替尼是一种小分子多靶点酪氨酸激酶抑制剂,通过抑制血管生成发挥抗肿瘤作用。本研究旨在评价阿得贝利单抗联合法米替尼治疗BM、PD-L1≥50%的晚期NSCLC的疗效和安全性。
研究设计:
BRAIN-AF01是一项前瞻性、单中心、单臂II期临床研究。PD-L1表达≥50%的晚期NSCLC伴BM的患者符合入组条件。基线时,患者需至少有一个可测量的颅内病变(定义为颅内病灶大小≥5mm),且既往未接受过NSCLC系统性治疗。约32例患者将接受阿得贝利单抗(1200mg,静脉输注,Q3W)联合法米替尼(20mg,D1,口服,QD),持续治疗直至疾病进展、撤回知情同意、出现不可耐受毒副反应或满足其他停药标准。主要终点是客观缓解率(ORR)。次要终点包括无进展生存期(PFS)、疾病控制率(DCR)、颅内ORR (iORR)、颅内PFS (iPFS)、总生存期(OS)和安全性。探索性终点为与脑脊液比较的外周血药物浓度、代谢组学特征、动态ctDNA基因组特征和基于多模态3T/7TMRI的影像组学特征。
临床试验注册号:ChiCTR2300079126
参考文献:
1.http/cslide.ctimeetingtech.com/elcc24hybrid/attendee/confcal_1/presentation
2.Caicun Zhou, et al. First-line camrelizumab (Camre) plus carboplatin (Carbo) and pemetrexed (Pem) for advanced non-squamous NSCLC: 5-yr outcomes of CameL phase 3 study. 2024 ELCC. 61P.
声明:
1. 本新闻旨在发布医药前沿资讯,仅供医疗卫生专业人士参阅,非广告用途。
2. 本公司不对任何药品和/或适应症作推荐。
3. 本新闻中涉及的信息仅供参考,请遵从医生或其他医疗卫生专业人士的意见或指导。医疗卫生专业人士作出的任何与治疗有关的决定应根据患者的具体情况并遵照药品说明书。