2024-09-18
2024 ESMO口头报告|金年会 金字招牌诚信至上创新药SHR-1701联合化疗一线治疗HER2阴性晚期胃癌的全国多中心3期研究获得阳性结果
2024年欧洲肿瘤内科学会(ESMO)大会于9月13日至17日在西班牙巴塞罗那举行。期间,北京大学肿瘤医院彭智教授以口头报告的形式公布了“SHR-1701联合化疗对比安慰剂联合化疗用于HER2阴性胃或胃食管结合部腺癌(G/GEJA)晚期一线的3期临床研究”数据1。该研究由北京大学肿瘤医院沈琳教授担任主要研究者,结果显示1,SHR-1701联合化疗一线治疗HER2阴性G/GEJA患者总生存期(OS)获益显著,有望为此类患者提供治疗新选择。

2024 ESMO现场图:彭智教授进行口头报告
研究背景
免疫治疗的出现改变了HER2阴性胃癌晚期一线标准治疗的格局。免疫检查点抑制剂(ICI)联合氟尿嘧啶类和铂类双药化疗改善了PD-L1(程序性死亡分子配体1)表达人群的预后2-3。尽管取得了这些进展,但胃癌领域的治疗仍面临较大挑战,亟需新型的治疗策略。鉴于TGF-β和PD-L1通路之间不重复的免疫抑制功能,阻断TGF-β通路可加强ICI对肿瘤的治疗作用4-7。
SHR-1701是金年会 金字招牌诚信至上自主研发的一种抗PD-L1/TGF-βRII(转化生长因子β受体II)双功能融合蛋白。在剂量递增、剂量扩展和临床扩展的1期研究中,SHR-1701单药用于胃癌末线人群显示出良好的抗肿瘤活性8。在此基础上,金年会 金字招牌诚信至上开展了这项SHR-1701联合化疗用于晚期G/GEJA的3期临床研究。
研究方法
本研究是一项全国多中心、2阶段、3期临床研究(NCT04950322),第1阶段目的是探索SHR-1701推荐剂量为30mg/kg Q3W,联合CAPOX(奥沙利铂+卡培他滨)的安全性和耐受性,第2阶段为多中心、随机、双盲,旨在确证SHR-1701联合CAPOX的疗效。入组人群为不可切除局部晚期或转移性G/GEJA、未接受过系统治疗、HER2表达阴性、ECOG PS评分为0或1、按照RECIST 1.1标准至少有1处可测量病灶;受试者随机1:1分配至试验组和对照组,干预方案分别为SHR-1701或安慰剂联合CAPOX。
主要终点为PD-L1 CPS≥5和意向治疗人群(ITT)的总生存期(OS),次要终点为无进展生存期(PFS)、客观缓解率(ORR)、缓解持续时间(DoR)和安全性。分层因素为PD-L1表达(综合阳性分数CPS≥5 vs.<5)、ECOG PS(0vs.1)和腹膜转移(有vs.无)。
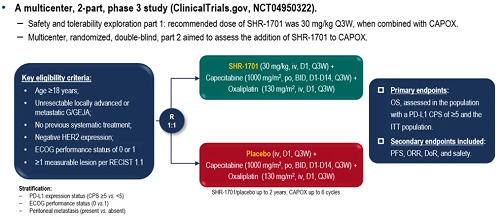
图1. 研究设计
主要结果截至2024年5月20日,SHR-1701组和安慰剂组分别入组365例和366例受试者。
1.OS数据
● PD-L1 CPS≥5人群中,SHR-1701组和安慰剂组分别发生93例(37.8%)和149例(60.1%)OS事件,中位生存期(mOS)分别为16.8个月(95% Cl:14.7-NR)和10.4个月(95% Cl:9.0-12.1),HR=0.53(95% Cl:0.40-0.68),p<0.0001,金年会app登录达到统计学差异。
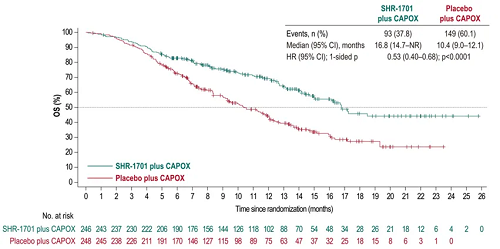
图2. PD-L1 CPS≥5人群中的OS
● ITT人群中,SHR-1701组和安慰剂组分别发生153例(41.9%)和208例(56.8%)OS事件,mOS分别为15.8个月(95% Cl:14.0-16.9)和11.2个月(95% Cl:9.4-12.1),HR=0.66(95% Cl:0.53-0.81),p<0.0001,达到统计学差异。
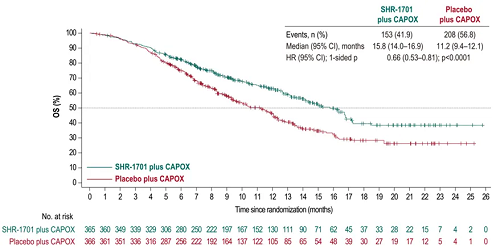
图3. ITT人群中的OS
2.盲态独立中心(BICR)评估的PFS、ORR和DoR
● PD-L1 CPS≥5人群中,SHR-1701组和安慰剂组分别发生133例(54.1%)和180例(72.6%)PFS事件,中位无进展生存期(mPFS)分别为7.6个月(95% Cl:6.5-9.3)和5.5个月(95% Cl:4.4-5.6),HR=0.52(95% Cl:0.42-0.66)。SHR-1701组和安慰剂组确认的ORR分别为56.5%(95% Cl:50.1-62.8)和32.7%(95% Cl:26.9-38.9),差异为23.8%(95% Cl:15.1-32.0)。DoR分别为10.2个月(95% Cl:7.7-17.6)和5.1个月(95% Cl:4.3-5.6)。
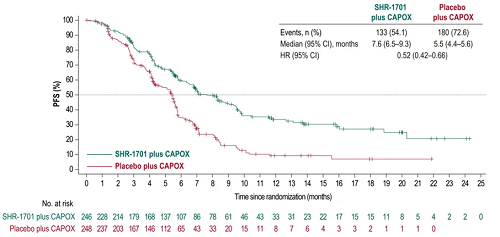
图4. PD-L1 CPS≥5人群中的PFS
● ITT人群中,SHR-1701组和安慰剂组分别发生202例(55.3%)和256例(69.9%)PFS事件,mPFS分别为7.0个月(95% Cl:6.6-8.3)和5.5个月(95% Cl:5.1-5.6),HR=0.57(95% Cl:0.48-0.69)。SHR-1701组和安慰剂组确认的ORR分别为53.4%(95% Cl:48.2-58.6)和32.8%(95% Cl:28.0-37.9),差异为20.6%(95% Cl:13.5-27.5)。DoR分别为8.5个月(95% Cl:7.0-13.0)和5.3个月(95% Cl:4.5-5.8)。
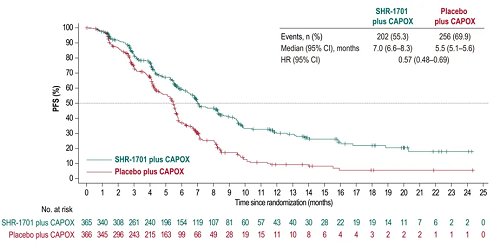
图5. ITT人群中的PFS
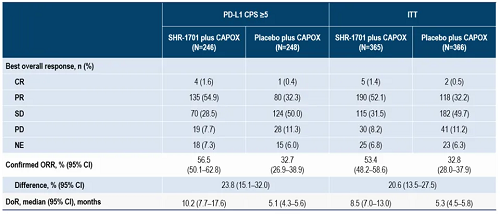
表. BICR评估的肿瘤反应
研究结论
这项3期研究取得了阳性结果,数据提示,SHR-1701联合CAPOX方案用于局部晚期或转移性HER2 阴性G/GEJA患者,较安慰剂联合CAPOX组具有显著的生存获益,且耐受性良好,没有观察到新的安全性信号。尤其是在PD-L1 CPS≥5的人群中,可以观察到更多的获益趋势。SHR-1701联合CAPOX有望为未经治疗的不可切除局部进展期或转移性HER2阴性G/GEJA患者提供新的治疗福音。
作为创新型国际化制药企业,金年会 金字招牌诚信至上长期坚持“科技为本,为人类创造健康生活”的使命,针对肿瘤等严重威胁人类生命健康的疾病持续开展科研攻关,已上市的17款1类创新药中抗肿瘤创新药达9款。公司另有90多个自主创新产品正在临床开发,300余项临床试验在国内外开展。本次ESMO大会,公司携13款创新药的37项抗肿瘤领域研究登上国际学术舞台,奏响了抗肿瘤领域自主创新实力的强音,也是菲律宾医药研发创新力量的展现。
除晚期胃癌外,SHR-1701目前还在肺癌、直肠癌、鼻咽癌等多领域开展临床研究,未来将有望金年会app登录揭晓更多循证证据,期待SHR-1701为更多肿瘤患者带来治疗新希望。
未来,金年会 金字招牌诚信至上将继续坚持“以患者为中心”的理念,重创新,强研发,力争研制出更多的新药、好药,服务“健康菲律宾”,惠及全球患者。
参考文献:
1.Shen L, Peng Z, et al. Phase 3 study of SHR-1701 versus placebo in combination with chemo as first-line (1L) therapy for HER2-negative gastric/gastroesophageal junction adenocarcinoma (G/GEJA).2024 ESMO LBA60.
2.Lordick F, Carneiro F, Cascinu S, et al. Gastric cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022;33(10):1005-1020.
3.NCCN Clinical Practice Guidelines.
4.Batlle E, Massagué J. Transforming Growth Factor-β Signaling in Immunity and Cancer. Immunity. 2019;50(4):924-940.
5.Mariathasan S, Turley SJ, Nickles D, et al. TGFβ attenuates tumour response to PD-L1 blockade by contributing to exclusion of T cells. Nature. 2018;554(7693):544-548.
6.Huang CY, Chung CL, Hu TH, Chen JJ, Liu PF, Chen CL. Recent progress in TGF-β inhibitors for cancer therapy. Biomed Pharmacother. 2021;134:111046.
7.Kim BG, Malek E, Choi SH, Ignatz-Hoover JJ, Driscoll JJ. Novel therapies emerging in oncology to target the TGF-beta pathway. J Hematol Oncol. 2021;14:55.
8.Liu D, Zhou J, Wang Y, et al. Bifunctional anti-PD-L1/TGF-βRII agent SHR-1701 in advanced solid tumors: a dose-escalation, dose-expansion, and clinical-expansion phase 1 trial. BMC Med. 2022;20(1):408. Published 2022 Oct 25.